1. ¿Qué es el soluto y qué es el disolvente en una disolución?
En una disolución de una sustancia en otra, la sustancia disuelta se denomina soluto. La sustancia donde se disuelve el soluto se denomina disolvente. Cuando la cantidad relativa de una sustancia en una disolución es mucho mayor que la de otra, la sustancia presente en mayor cantidad se considera generalmente como disolvente.
2. Menciona las expresiones de las concentraciones en unidades químicas.
Molaridad (M)
Formalidad (F)
Normalidad (N)
Molalidad (m)
Fracción molar (Xi)
Porcentaje peso-peso (%p/p)
Porcentaje peso-volumen (%p/v)
Porcentaje volumen-volumen (% v/v)
Partes por millón (ppm)
Partes por billon (ppb)
3. ¿Cómo se calcula cada una de ellas?
M = numero de moles / Litro de disolución
N= Número de equivalentes-gramo / litro de disolución
m= número de moles / kilogramo de disolvente
Xi= número de moles del soluto dividido entre el número de moles totales.
% p/p= (masa del soluto / masa de disolución) * 100
% peso-volumen = (masa del soluto / volumen de disolución (ml)) * 100
% volumen-volumen = (volumen de soluto / volumen de disolución) * 100
4. ¿Qué es una dilución y cómo se calcula?
Se refiere a la reducción de la concentración de una sustancia química.
Se calcula con la fórmula
M1 * V1 = M2 * V2
Donde
M1 = Concentración 1
V1 = Volumen 1
M2 = Concentración 2
V2 = Volumen 2
5. Cuál será la molaridad de una solución de amoníaco que se obtiene diluyendo 20 ml de amoníaco acuoso concentrado (26 % p/p, densidad = 0,90 g/ml), hasta completar un volumen final de 50 ml?
Cuando se prepara una solución más diluida debe tenerse en cuenta que:
C1 x V1 = C2 x V2
Si se desea hallar la molaridad es necesario tener la concentración de la solución de la que se parte expresada en molaridad.
Se tiene 26 g / 100 g solución = 26 g / 100 g solución : 0.9 g solución / ml solución = 26 g soluto / 111,11 ml solución =
= 26 g /17 g/mol : 111,11 ml = 1,53 moles / 0,111 litro solución = 13,78 M
C2 = 20 ml x 13,78 M / 50 ml = 5,52 M
7. Define qué son las propiedades coligativas y menciona cada una de ellas.
Las propiedades coligativas son aquellas propiedades físicas que presentan las soluciones, y dependen únicamente de la concentración molal.
Aumento o Disminución de la Tensión o Presión del Vapor
Aumento del punto de Ebullición
Disminución del Punto de Fusión
Presión Osmótica de la Solución
Una medida del grado en que los electrolitos se disocian es el factor de Van’t Hoff . Este factor es la relación entre el valor real de una propiedad coligativa y el valor calculado (considerando que la sustancia es un no electrolito). Al factor ideal de Van’t Hoff se le simboliza por la letra √, (nu).
9. ¿Qué es el potencial químico?
La tendencia de una sustancia a reaccionar con otras sustancias, transformarse en otro estado, redistribuirse espacialmente, puede ser expresada por una única cantidad. El potencial químico μ, es una medida de la magnitud de ésta tendencia.
10. ¿Cuáles son los principales osmolitos orgánicos?
Estos solutos caen en una categoría química como son: los hidratos de carbono pequeños, incluyendo los azúcares (trehalosa, por ejemplo), polioles (glicerol, inositoles, sorbitol, etc) y derivados (por ejemplo, como o-metil-inositol), aminoácidos (glicina, prolina, taurina, etc) y derivados (por ejemplo, ectoine); metilaminas [como N-óxido de trimetilamina (OTMA) y la glicina betaína] y solutos de metilsulfonio incluyendo dimetilsulfonopropiato (DMSP), y la urea.
11. Menciona las principales propiedades citoprotectoras que poseen los osmolitos y que participan en las reacciones metabólicas
Antioxidación (estrés en plantas)
Balanceo Redox, Protección contra hipoxia (Algas)
Detoxificación de sulfidos (Ventílación tubícula endotérmica)
Reserva de energía (ectotermos)
Repelente a los depredadores (diatomeas)
Modulación de Calcio (neuronas)
12. ¿En que consiste la bioenergética?
13. Da ejemplos de las posibles aplicaciones que tiene la bioenergética en los sistemas biológicos.
El Metabolismo : Conjunto de transformaciones que experimenta la materia externa desde su absorción o adición al citoplasma, hasta su eliminación del mismo. Por ejemplo, las células están compuestas por un complejo sistema de reacciones químicas que generan energía y otras que utilizan energía, esto en general es el Metabolismo.
El ATP: En general, el ATP o trifosfato de adenosin es la conexión entre los sistemas que producen la energía y los que la utilizan; la degradación oxidativa de los alimentos es un proceso exergónico 'son endergónicos y utilizan la energía química almacenada en forma de ATP y NADH.
14. ¿Define el potencial de membrana y porqué se produce?
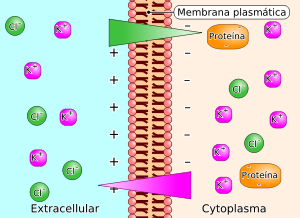
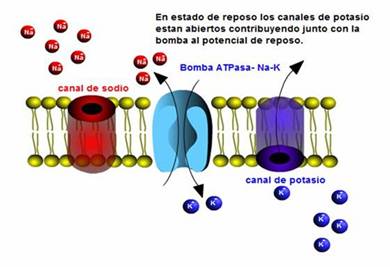
El potencial de membrana se refiere a la diferencia de cargas eléctricas a través de la membrana plasmática. Fuera de la membrana tiene carga positiva debido a los iones Na+ y Ca2+ en grandes concentraciones y por dentro de la membrana la carga es negativa debido a grupos cargados negativamente en el citoplasma.
El potencial de membrana se genera, porque existe una distribución desigual de iones a través de la misma, y porque la membrana tiene permeabilidad selectiva para las especies iónicas presentes.
Esto significa que existe un gradiente de concentración para las especies iónicas mayoritarias presentes.
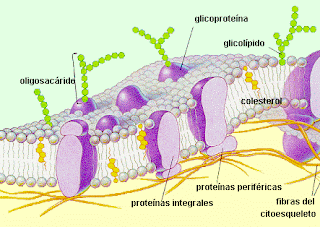
Si las membranas biológicas fueran simplemente una membrana bicapa fosfolipidica, totalmente impermeable a los iones, no se generaría un potencial de membrana, aunque existieran gradientes electroquímicos importantes a través de ella.
15. ¿Qué es el equilibrio Donnan?
Es el equilibrio que se produce entre los iones que pueden atravesar la membrana y los que no son capaces de hacerlo.