El potencial de membrana hace referencia a la diferencia de caragas eléctricas a través de la membrana plasmatica. Fuera de la membrana esta cargado positivamente debido a los iones Na+ y Ca2+ en grandes concentraciones y por dentro de la membrana es negativo debido a grupos cargados negativamente en el citoplasma.
COMO SE GENERA EL POTENCIAL DE MEMBRANA
COMO SE GENERA EL POTENCIAL DE MEMBRANA
El potencial de membrana se genera, porque hay unan distribución desigual de iones a través de la misma, y porque la membrana tiene permeabillidad selectiva para las especies iónicas presentes.
En la mayoría de las células, existe una alta concentración de potasio y de aniones no permeables en el interior celular, mientras que el sodio y el cloruro se presentan en mayor concentración en el exterior. Esto significa que existe un gradiente de concentración para las especies iónicas mayoritarias presentes.
Si las membranas biológicas fueran simplemente una membrana bicapa fosfolipidica, totalmente impermeable a los iones, no se generaría un potencial de membrana, aunque existieran gradientes electroquímicos importantes a través de ella.
ECUACIÓN DE NERNST
1- Las membranas celulares son un mosaico fluido de lípidos y proteínas.
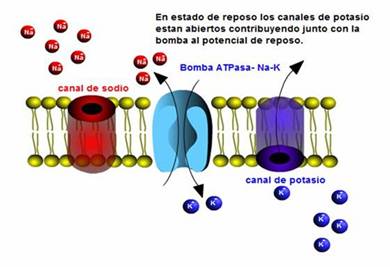
Las membranas son impermeables a los iones, al ser hidrofóbicas, por lo tanto los iones deben atravesarla por Canales, que son proteínas especializadas de membrana, que pueden tener una alta selectividad o selectividad relativa para los iones, y pueden estar abiertos o cerrados.
CONSIDEREMOS UNA CELULA CON UNA MEMBRANA EXCLUSIVAMENTE PERMEABLE AL POTASIO
¿Qué pasará?
Dado que la concentración de potasio es mayor adentro que fuera de la célula, el potasio tenderá a salir de la misma, tal como tienden a salir de un saquito de té, los pigmentos y otras sustancias que dan sabor . En la medida que el potasio sale de la célula, genera una separación de cargas. Dado que cargas de signos opuestos se atraen, y las de signo opuesto se repelen, el exceso de cargas positivas del exterior tenderán a distribuirse sobre la cara externa de la membrana, y el exceso de cargas negativas del interior tenderán a ubicarse sobre la cara interna de la membrana. DE esta manera se dice que la membrana se polariza. En otras palabras, se genera un gradiente eléctrico a través de la membrana. El exceso de cargas positivas del exterior, se opondrán a la salida de más potasio de la célula.
El punto en el cual la diferencia de potencial se opone y contrarresta exactamente al flujo del potasio, es conocido como POTENCIAL DE EQUILIBRIO PARA EL ION POTASIO. A ese potencial no hay más flujo neto espontáneo del potasio a través de la membrana.
2- El potencial de equilibrio para el potasio u otro ion permeable, está determinado por el gradiente de concentración y es proporcional a la diferencia entre el logaritmo de las concentraciones del ion, a ambos lados de la membrana, según la siguiente ecuación:
ΔΨ = k (ln[K]afuera - ln [K]adentro)
Donde:
ΔΨ : Diferencia de Potencial de membrana
k = RT/zF. R (0,00831831 KJ / 0K mole),
T 298 Kelvin,
z es la Valencia del ion con su respectiva carga.
F = Faraday (96,500 KJ / V mol.
k = RT/zF. R (0,00831831 KJ / 0K mole),
T 298 Kelvin,
z es la Valencia del ion con su respectiva carga.
F = Faraday (96,500 KJ / V mol.
Reorganizando, la ecuación de Nernst queda así:
ΔΨ = (RT/zF) (ln [K]afuera - ln [K]adentro)
ΔΨ = (RT/zF) (ln [K]afuera - ln [K]adentro)
DATOS IMPORTANTES
A temperatura ambiente
RT/zF, para un ion monovalente es aproximadamente 25 mV
A temperatura ambiente
RT/zF, para un ion monovalente es aproximadamente 25 mV
Para trabajar con logaritmos decimales (log, es decir, en base diez), en lugar de logaritmos neperianos ( base 2,303), se multiplica ln por 2,303, y por lo tanto el valor
25 mV pasa a 58 mV.
Por lo tanto la expresión de la ecuación de Nernst con estos datos es:
ΔΨ = 58 mV log [K]afuera / [K]adentro
La Ecuación de Nernst puede ser usada para encontrar el potencial de equilibrio para cualquier ion permeable, cuyas concentraciones intra y extracelulares son conocidas.
Por ejemplo, veamos para el caso que el Na+ extracelular sea 117 mM y la intracelular 30 mM:
ΔΨ =58mV log 117/ 30= + 34 mV
Para el caso del Cl-, con una concentración de 120 mM afuera y 4 mM adentro
ΔΨ = - 58mV log 120/ 4 = - 85 mV ( recordar que z en este caso es –1).
3- Si el potencial de membrana es diferente del potencial de equilibrio para un determinado ion, el gradiente de concentración de ese ion tenderá a cambiar, para restablecer el equilibrio.
Si se despolariza una celula por ingreso de potasio ( el interior se vuelve menos negativo), y el potencial de membrana disminuye, el potasio tenderá a salir de la célula.
Si se hiperpolariza la célula haciendo más negativo el interior y por lo tanto aumentando la diferencia de potencial, el potasio tendera a ingresar en la célula.
Ecuación de Goldman-Hodgkin-Katz (aplicable a membranas permeables a múltiples iones)
Tal como se vio anteriormente, la ecuación de Nerst solo calcula el potencial de difusión para un ion en particular, es decir, se asume que en el medio externo sólo existe un tipo de iones (por ejemplo: Na+).
Se sabe que tanto en los medios intra y extra celular existen múltiples iones tales como: Na+, K+, Cl-, Mg2+, entre otros, por lo tanto es necesario disponer de una fórmula que calcule dicho potencial para todos los iones presentes en el líquido extracelular.
Se sabe que la membrana celular es permeable a múltiples iones diferentes, por lo tanto al momento en que dichos iones difunden se genera un potencial de membrana que depende de tres factores:
La polaridad de la carga de cada uno de los iones a difundir.
La permeabilidad de la membrana a cada uno de los iones.
Las concentraciones de los mismos tanto en el exterior como en el interior de la membrana.
La Ecuación de Goldman (también llamada de Goldman - Hodgkin - Katz) calcula el Potencial de la membrana en el interior de la célula cuando participan dos iones positivos univalentes (K+ y Na+) y un ion negativo también univalente (Cl-).
MANTENIMIENTO DE GRADIENTES DE CONCENTRACION DE Na+ y K+
Dado que ni el Na ni el K están en sus potenciales de equilibrio en una célula polarizada con un determinado potencial de membrana, en esas condiciones, el potasio tiende a salir y el sodio a entrar. Con el tiempo, esto llevaría a la disipación del gradiente de concentración de ambos iones y a la pérdida del potencial de membrana.
El gradiente de concentración iónico por lo tanto, debe mantenerse con el funcionamiento de las bombas.
El gradiente de concentración iónico por lo tanto, debe mantenerse con el funcionamiento de las bombas.
Las Bombas juegan un rol crucial en el mantenimiento del balance osmótico de la célula.
Sabemos que las células contienen aniones intracelulares no permeables
( ATP, proteínas, nucleótidos). Si las bombas no funcionaran, la osmolaridad intracelular excedería a la extracelular en condiciones de equilibrio electroquímico, el agua entraría violentamente a la célula que podría explotar.
( ATP, proteínas, nucleótidos). Si las bombas no funcionaran, la osmolaridad intracelular excedería a la extracelular en condiciones de equilibrio electroquímico, el agua entraría violentamente a la célula que podría explotar.
REFERENCIAS BIBLIOGRÁFICAS
biofisica.fcien.edu.uy/potencial_de_membrana.pdf
http://www.elergonomista.com/biologia/biofisica12.html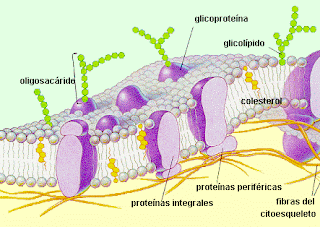
No hay comentarios:
Publicar un comentario